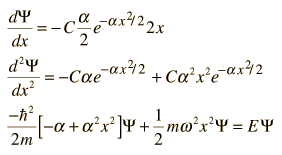Thursday, March 22, 2012
Aromaatsete ühendite vooluringest
Aromaatsed ühendid sisaldavad süsinikrõngaid ning sellesse aineklassi kuuluvad benseen ja ülal olev naftaleen. Need ühendid võivad välise magnetvälja mõjul oma magnetvälja tekitada. See effekt ise on olulisem tuuma magnetresonantsi (NMR) kasutamisel aine tuvastamisel. NMR's tekitab osades aatomituumades kindlat neile omast raadiosagedust, mille sagedus kasvab intentsiivsemas magentväljas olles.
Magnetvälja teket saab suures skaalas võrrelda elektromagnetiga kus laengu vool läbi juhtmerõnga tekitab rõngast vooluga risti läbiva magnetvälja. Aromaatsetes ühendites on rõngasmolekul ise juhtme rollis ning selles tekkinud elektronide liikumine on magnetvälja tekitajaks. Ülaillustratsioonil on väline magnetväli tähistatud punaselt. Selle mõjul tekkinud elektrivool on tähistatud kollaselt ja rõnga voolu poolt tekitatud magnetväli lillalt.
Rõnga keskosa on magnetvälja mingil määral blokeeritud, sest magnetväljad oleksid vastassuunalised. Rõngast välja jäävad aatomid on intentsiivsemas magnetväljas, sest väline magnetväli ja molekuli enda tekitatud magnetväljad on väljaspool samasuunalised.
Näiteks benseenis suurendab magnetväljade võimendumine ~7 miljondiku võrra suuremat raadiosagedust.
Rõngaste sisesed prootonid tekitavad nõrgema magnetvälja tõttu väiksema sagedusega raadiolaineid. Ülemise C18H18 üldvalemiga molekulis on keskmised 6 prootonit ~3 miljondiku võrra aeglasema sagedusega.
Antiaromaatsetes molekulides on magnetvälja blokeerimine ja võimendus vastupidine aromaatsete ühendite omaga. Sellistes ainetes on sisemised prootonid suurema NMR sagedusega ning väljapoole jäävad alad on magnetvälja eest rohkem kaitstud.
Antiaromaatsetel ühenditel nagu ülal on omaseks vaheldumisi üksik- ja kaksiksidemete esinemine aatomite vahel ning molekul on rõngakujuline. Benseen oleks eelmise lause järgi antimaromaatne kuigi benseen on aromaatne ühend.
Teine tingimus antiaromaatsuseks on eeldus, et pii sideme elektrone on 4 korda täisarvu jagu (benseenil paistab neid 6). Pii sideme kuju on üleval kollaselt näha.
Benseenis (C6H6) arvutatud magnetvälja tekitatud voolusuunade üldpilt. Magnetväli oli rõnga tasapinnaga täisnurga all. Vasakul on läbilõige molekulist ning paremal on arvutatud tasapinnast 52 pm kaugemal oleva piirkonna elektrivool. Rõnga keskel paistab teispidi vool kui väljaspool rõngast. Vektorid on 0,01-0,1 nanoamprit (~60-600 miljonit elektroni või prootoni laengut sekundis) iga tesla kohta.
Wednesday, March 21, 2012
Kerri effekt
Kerr'i effekt on aine murdumisnäitaja (n) muutus välise elektrivälja mõjul. See nähtus esineb igas materjalis kuid osades vedelikes (tavaliselt süsinikrõngast sisaldavate molekulidega) on see ilmsem.
Muutus murdumisnäitajas on leitav valemiga:
kus muutus murdumisnäitajas võrdub lainepikkus korda Kerri konstant K korda elektrivälja tugevus E ruudus. K väärtus on kristallides 10-18 kuni 10-14 ja vedelikes tavaliselt 10-22 kuni 10-19. Suurema K väärtusega kulub sama erinevuse tekitamiseks murdumisnäitajas vähem elektrit. Kui elektriväli on valgusega täisnurkse nurga all, siis võib selline materjal aine polarisatsiooni muuta.
Ühe olukorrana võib elektrivälja saava vedeliku panna kahe omavahel täisnurga all oleva polariseeriva filtri vahele (sarnaselt ülapildi kahe polaroidiga), et blokeerida valguse läbimine. Elektrivälja lisamisel nihutaks sees olev materjal Kerr'i effekti abil valguse polarisatsiooni, nii et rohkem valgust pääseks nende kahe polariseeriva filtri vahelt läbi sarnaselt ülapildil kahe polaroidi vahele pandud kolmanda polaroidiga.
Kaks suurema K väärtusega ainet on vasakpoolsem nitrotolueen ja parempoole nitrobenseen. Ühte neist vedelikest sisaldavat anumat (Kerr cell) saab kasutada valguse läbipääsu kiireks reguleerimiseks, sest see effekt on kiire ning 10 GHz on üks saavutatav valguse moonutamise kiirus. Tavaliselt kulub 30 000 volti täieliku läbipaistvuse tekitamiseks.
Kuna see effekt on ülikiire, siis saab vahelduvvoolu asemel kasutada valguse enda elektrivälja. Sellist valguse kasutamist on kasutatud laserites, mis suurema intentsiivsuse saavutamisel suuremat Kerr'i effekti tekitavad. See võimaldab ka sobivate omadustega valgusel läätsesid soovitud viisil läbida ning kui valgus pole õige, siis ei töötaks kindla kiire jaoks valitud läätsed ideaalselt suunavad või koondavalt.
Muutus murdumisnäitajas on leitav valemiga:
kus muutus murdumisnäitajas võrdub lainepikkus korda Kerri konstant K korda elektrivälja tugevus E ruudus. K väärtus on kristallides 10-18 kuni 10-14 ja vedelikes tavaliselt 10-22 kuni 10-19. Suurema K väärtusega kulub sama erinevuse tekitamiseks murdumisnäitajas vähem elektrit. Kui elektriväli on valgusega täisnurkse nurga all, siis võib selline materjal aine polarisatsiooni muuta.
Ühe olukorrana võib elektrivälja saava vedeliku panna kahe omavahel täisnurga all oleva polariseeriva filtri vahele (sarnaselt ülapildi kahe polaroidiga), et blokeerida valguse läbimine. Elektrivälja lisamisel nihutaks sees olev materjal Kerr'i effekti abil valguse polarisatsiooni, nii et rohkem valgust pääseks nende kahe polariseeriva filtri vahelt läbi sarnaselt ülapildil kahe polaroidi vahele pandud kolmanda polaroidiga.
Kaks suurema K väärtusega ainet on vasakpoolsem nitrotolueen ja parempoole nitrobenseen. Ühte neist vedelikest sisaldavat anumat (Kerr cell) saab kasutada valguse läbipääsu kiireks reguleerimiseks, sest see effekt on kiire ning 10 GHz on üks saavutatav valguse moonutamise kiirus. Tavaliselt kulub 30 000 volti täieliku läbipaistvuse tekitamiseks.
Kuna see effekt on ülikiire, siis saab vahelduvvoolu asemel kasutada valguse enda elektrivälja. Sellist valguse kasutamist on kasutatud laserites, mis suurema intentsiivsuse saavutamisel suuremat Kerr'i effekti tekitavad. See võimaldab ka sobivate omadustega valgusel läätsesid soovitud viisil läbida ning kui valgus pole õige, siis ei töötaks kindla kiire jaoks valitud läätsed ideaalselt suunavad või koondavalt.
Monday, March 19, 2012
Elektronorbitaalide kujust
Elektroni täpsem asukoht sõltub elektroni kvantarvudest. Kvantarv n tähistab energiataset ning seda võib mingil määral võrrelda raadiusega aatomi keskosast, sest energilisemad elektronid on tuumast kaugemal. Teine kvantarv l kirjeldab alamelektronkihti. Selle väärtused on 0 kuni n-1. Näiteks n=1 korral on l väärtus 0, mis tähistab esimese s orbitaali energiataset. Edasi kasvava l väärtusega on järjest esimesed p, d ja f orbitaalid.
Kolmas kvantarv ml kirjeldab täpsemat asukohta l orbitaali sees olles väärtusega -l kuni +l.
Neljas kvantarv ms, mis kirjeldab spinni ei ole orbitaali kuju muutev.
Ülal illustratsioonil on roosa alaga vibreeriva kvantosakese asukohtade tõenäosusjaotused. Vertikaaltelg näitab tõenäosust ja horisontaaltelg kaugust keskkohast. Suurus n tähistab vastavat kvantarvu. Väikese n väärtusega kaldub elektron keskosas esinema kuid n väärtuse tõstmisega saab elektroni järjest kaugemalt leida ning suureneb tõenäosus, et see ei ole keskosas.
Näiteid elektroni asukoha tõenäosusest (a0 on ~0,05 nm):
Elektronorbitaalide kuju saab illustreerida kera näitel (spherical harmonic).
Selle täpsema tähistusega pandakse l ja m väärtused selle järele. Arvutuskäik ise on pikk kuid alumisel keradega illustratsiooni mäletamisel saab elektronorbitaalide kuju mäletada. Sellist Y arvutamist kasutatakse ka gravitatsiooniväljade tähistuses.
Väärtus l näitab mitu vertikaalset või horisontaalset rõngast on ümber kera. Kõige vähem energiline 1s kiht on sujuvalt kerakujuline (elektron on ühtlases kerakujulises piirkonnas umbes ühtlaselt tõenäoliselt) ning selle l=0. Triipude ületamisel vahetub väärtuse + ja - märk. Kvantarv m on ülal vertikaalse rõngaste hulka näitav. Kui m on sama palju kui l, siis on kõik rõngad vertikaalsed ning m=0 olukorras on kõik rõngad horisontaalsed. Saadud üldkujud sarnanevad esimesel illustratsioonil näidatud elektronorbitaalide kujudega (+ ja - asemel on punane ja sinine värv). Näiteks l=3 m=3 pilt on ülal näha kahe kõige parempoolsema pildi peal samasuguse üldkujuga. Neile kahele eelnenud kaks on kvantarvudega l=3 m=2 mis sarnaneb kera näitel illustreerituga.
Arvudega näide, kus punasuse järgi näeb täpsemat tõenäosust. Näha on ka arvuliste väärtuste kasv kui arvutada natuke suuremate kvantarvudega. Miinus või plussmärk m väärtuse ees ei muuda orbitaalide kuju. Ülevaade selliste väärtuste leidmisest erinevate kvantarvude jaoks.
Sunday, March 18, 2012
Pauli printsiip
Pauli printsiibi järgi ei saa samas kohas olla korraga kahte samade kvantarvudega fermioni. Fermionide hulka kuuluvad elektronid ja kvargid, mis moodustavad neutronid ja prootonid.
Lihtsustatult leiab osakese esinemise tõenäosuse mingis punktis kui korrutada tõenäosused, et esimene elektron on ühes kohas ja teine teises kindlas kohas. Samas ei ole elektronid aatomi sees eristatavad ja õigem on arvestada iga elektroni puhul selle esinemist igas võimalikus kohas.
Ülemine pikendatud valem leiab tõenäosuse, et kahes uuritavas kohas on elektrone sõltumata sellest kumb konkreetne elektron on kummas kohas. See tehe annab tõenäosuseks nulli kui mõlemad elektronid oleks korraga samas mõlemas võimalikus kohas, mis tähendaks, et reaalselt ei tohiks elektron olla korraga mitmes kohas samal ajal.
Selline piirang puudub bosonitel nagu näiteks footonitel, millel puudub limiit kui palju neid võib ühes kohas olla ning nende esinemistõenäosused liidetakse kokku.
Pauli printsiibi roll gaasilise (tahkes NaCl's oleks eV ja r väärtused teised) NaCl ioonsidemes. Horisontaaltelg näitab distantsi tuumade vahel ja vertikaaltelg potentsiaalset energiat. Naatriumi välise elektroni saab eemaldada 5,14 eV energiaga ja kloor võtab vastu elektroni vabastades 3,62 eV energiat. Erinevuseks olev 1,52 eV on piisav ühinemise põhjustamiseks kui kloori ja naatriumi ioonid on üksteisest kaugel. Kui need ioonid üksteisele lähemale viia, siis põhjustavad nende vastupidised laengud tõmmet, mis põhjustaks ise elektroni ülekannet. 0,94 nm kaugusel üksteisest on nende vastastikmõju energia 1,52 mis teeb elektroni ioonsideme tekke tõenäoliseks.
Kui Na ja Cl vaheline distants jääb alla 0,236 nm, siis hakkavad elektronid üksteisest eemale tõukuma sama laengu ja Pauli printsiibi tõttu. Kui ioonid asuvad kaugel, siis ei kattu nende elektronide lainefunktsioonid ja mõlemas aatomis võib esineda samade kvantarvudega elektrone kuigi mitte korraga samas aatomis. Lainefunktsioonide kattumisel ei saa elektronid samas kohas püsida ja on sunnitud järjest kõrgema energiatasemega elektronkihtidele. Sellega koos ei saa aatomid piiramatult läheneda, sest nende sisemised täidetud elektronkihid ei lase teise aatomi elektronkihtidel piiramatult läheneda.
Pauli printsiip tuumades. Tiheda aatomituuma avastamisel tekkis kahtluseid, et tugeva tuumajõuga osakesed võivad üksteisega kokku põrgata ja sellega potentsiaalselt energiat kaotada. Pauli printsiip välistas seda sarnaselt elektronidega. Selle järgi täidetakse tuumas alguses kõige vähemenergilised olekud ja siis edasi kõrgemad energiatasemed. Minimaalse energiataseme täitmisel ei saa tuumaosake rohkem energiat kaotada, sest juba oldakse minimaalse energiaga tasemel. Energiat saab lisada kuid energia eemalduse võimalus on võimalik siis kui ei olda miinimumtasemel.
Neutronite ja prootonite energiatasemed on sarnased ja see teeb tõenäolisemaks, et prootonite ja neutronite arv on ühtlane. Lihtsam on korraga täita 1 energiatase ühe neutroni ja prootoniga kui lasta prootonil või neutronil teisest osakesest mitme energiataseme võrra energilisem olla. Ebaühtlase prootonite ja neutronite arvuga kaasneb tavaliselt soodumus radioaktiivseks lagunemiseks, millest paistab tuumaenergia jaoks olulist erinevust energia sisalduses.
Fermi energia (tähistusega EF) on maksimaalne energia, mis võib olla elektronil absoluutse nulli juures. Ka absoluutse nulliga peaks kehtima seos, et vähemenergilised elektronid on aatomi keskosa lähedal ja energilisemad väliskihtidel.
Metallide fermi energia on suurusjärgus ~1-10 eV. Näiteks vasel on fermi energia 7 eV (umbes sama palju kulub vasest esimese elektroni eemalduseks) ja toatemperatuuril osakese soojusenergia oleks ~0,026 eV.
Fermi energiast vähem energiat omavad elektronid ei saa millegagi reageerida kuni mõjutaja ei suuda selle energiat tõsta üle fermi energia. Toatemperatuuri energia ei mõjuta tõenäoliselt elektronide energiatasemeid, sest elektronid võivad omastada energiat kui nad saavad piisavalt energiat uuele energiatasemele liikumiseks kuid tihti pole fermi energia lähedal sobivaid energiatasemeid.
Elektronid saavad footoni energiat omastada kui footonil on piisavalt energiat elektroni uuele energiatasemele tõstmiseks. Kui kõrgema energiaga elektronkiht on täidetud nagu näiteks neoonis, siis ei saa elektron ka sobivalt energilise footoni abil uuele energiatasemele.
Saturday, March 17, 2012
Kvantfüüsika lainevõrrandist
Üks kvantmehhaanika väiteid on see, et iga kvantosakest saab kirjeldada lainefunktsiooniga (sümboliga psii). Lainefunktsiooni järel tähistab x asukohta ja t aega. Lainefunktsiooni kaudu saab leida tõenäosuse, et osake asub x kohas t ajal. Kui x läheneb lõputusele, siis läheneb lainefunktsioon nullile. Üks psii tähistab tõenäosuse amplituuti ja psii ruudus annab tõenäosuse leida osakest mingist kohast.
Lainefunktsioon ei ole lihtne korrutustehe vaid selle kasutamisel peab leidma osatuletisi ning vahel läheb integraale vaja.
Tõenäosus leida osakest on 1 (100%), kui liita kokku osakese esinemise tõenäosused igas võimalikus punktis.
Lainefunktsioon on osaliselt imaginaararv (ülavalemites tähega j), mille ruut annab -1. Ülatärni (konjugaadi) esinemisel vahetatakse tehtes "+" ja "-" märgid. Lainefunktsiooni ja selle konjugaat korrutatakse omavahel ning selle käigus tekib imaginaararv ruudus, mis vahetatakse -1 vastu.
Kvantosakesi kirjeldav lainevõrrand sarnaneb osaliselt ühedimensioonilise nööril leviva laine võrrandiga:
Tasapinnalise elektromagnetkiirguse lainevõrrand.
Harmoonilise võnkumise võrrand ülal võrreldes selle kohal oleva võnkuva vedru potentsiaalse energia võrrandiga.
Lainefunktsiooni tuletis peab sisaldama konstanti ja x ruutu. Selline valem sobib lainefunktsioonina kuna kui x läheneks lõputusele, siis läheneks lainefunktsioon nullile.
Schrödingeri võrrandi lahendamisel saadav energia valem. Sellise harmoonilise võnkumise valemiga saab suhteliselt täpselt leida vibreerivate kahe aatomiga molekulide vibratsioonienergia asukoht kuigi täpsus langeb suuremate molekulidega.
Minimaalse energia leidmises alustades ülemise Schrödingeri valemiga.
Lihtsustatud kokkuvõttena antakse lainefunktsioonile ülemine kuju, mida kasutatakse tuletamises.
Pärast kahte tuletamist leitakse lainefunktsioon iga x väärtuse jaoks. X'i korrutav suurus a on püsiva väärtusega iga x väärtuse korral.
x ruutu panekud eemaldatakse mõlemast valemi poolest ja energia leidmiseks pandakse samade osakeste jaoks muutumatud suurused üksteisega võrdseks.
Saadud energia väärtus võrdub määramatuse printsiibi poolt minimaalse võimaliku energiaga, mis peaks esinema isegi jahutamisel absoluutse nullini. See energia võib olla põhjuseks, miks heelium atmosfäärirõhul ühegi temperatuuri juures ei külmu.
Võrdlus Newton'i võnkumise ja kvantmehhaanika vahel. Kvantmehhaanika kirjeldab hästi aatomi suurusjärgus osakesi ning Newton'i seadused suuri objekte. Vähemalt osades olukordades paistab nende kahe vahel peaaegu vastupidine käitumine.
Roosa alaga on tähistatud minimaalse energiaga lainefunktsioon psii null ruuduga ja hallide täppidega suure objekti käitumine. Mõlemas suurusjärgus toimuks võnkumine kahe punaselt tähistatud vertikaalse piiri vahel. Kõrgemal olek tähistab suuremat esinemise tõenäosust selles punktis. Vetruv suur objekt, mis kõiguks kahe seina vahel oleks kõige lühemat aega ruumi keskel kuna see lendaks kiiresti edasi ruumi teise otsa olles rohkem aega keskosast eemal. Kvantosakeste puhul paistab käitumine vastupidine. Võnkuv osake asub kauem ruumi keskel levides keskosast suhteliselt harva eemale. Ühe lisaomadusena on kvantosakesed barjääride poolt vähem piiratud ja võivad neid läbida (quantum tunneling).
Kui kvantosake on energilisem (suurema psii all näidatud kvantarvuga), siis käitub see suure objektiga sarnasemalt.
Kui kvantarv n=10, siis on kvantosakese asukoht ruumis sarnasem igapäevaelus paistva võnkuva objektiga olles kauem võnkumise piirialadel. Lainefunktsiooniga jääb kaduv ja taastekkiv esinemise tõenäosus, mis teeb tõenäosusjaotuse lünklikuks. Suurema n väärtusega lähenevad nende tõenäosuste tipud üksteisele.
Piisavalt suure n väärtusega ei oleks need tipud täpselt eristatavad, sest määramatuse printsiip piirab täpseid teadmisi kvantosakeste asukohast mingis ajas.
Klassikalise füüsika järgi ei saa osake läbida barjääri (quantum tunneling), kui osakese energia on vähem kui läbimiseks vajalik energia U0. Kvantfüüsikas võivad osakesed takistusi läbida kaotamata energiat kuigi väheneb tõenäosus, et osake esineb teisel pool takistust. Lainefunktsioon ise peab olema jätkuv isegi kui pool lainet jääks seina sisse või teisele poole takistust. Samas langeb seina läbiva osakese esinemise tõenäosus eksponentsiaalselt piirkonnas, kus lainefunktsioon läbib seina.
Lainefunktsiooni valem kui see läbib takistust energiabarjääriga U0. Alfa on nõrgenemise faktor ning mida suurem see on, seda rohkem lainefunktsiooni suurus väheneb. Mida suurem on osakese mass või mida suurem on U0 osakese energiaga võrreldes seda väiksema tõenäosusega läbib see takistust.
Friday, March 16, 2012
Nitraatgrupp lõhkeainetes
Ülal illustreeritud nitraatgrupp esineb peaaegu kõigis kuulsamates lõhkeainetes alates püssirohust. ~19. sajandi esimesel poolel õpiti seda sihilikumalt materjalidele lisama, et saada lõhkeainet kuigi tavaliselt on sellised ained ettearvamatult plahvatusohtlikud. Umbes Ameerika kodusõja paiku õpiti seda tselluloosile lisama, et kasvõi vatitükkidega kahurikuule lendama saata. Hiljem lisas Alfred Nobel nitraatgruppe glütseriini külge tekitades sellega nitroglütseriini.
Osalt võivad nitraatgrupid molekuli stabiilsust vähendada elektronegatiivsuse tõttu. Mida suurem on elektronegatiivsus seda tugevamalt üritab elektron sinna minna. Tavaliselt on nitraatgrupid kinnitunud süsiniku külge ja see tekitab vähemalt 3 aatomit pika raja, kus iga järgnev aatom üritab jõulisemalt elektrone püüda. Süsinik on neist kolmest nõrgim elektroni püüdja ja sellest edasi levib elektron lämmastiku ja hapniku külge jättes omavahel ühenduses süsiniku aatomite jaoks suhteliselt vähem elektrone. Kui süsinikel peaks tekkima elektronide puudus, siis hakkavad nende positiivse laenguga tuumad üksteisest eemale tõukuma ning kui lisada löök või kuumus, siis võib see põhjustada kiiret plahvatust.
Tihti lisatakse lõhkeainetele metalle nagu raud või alumiinium, mis annaks reaktsioonile elektrone (muuhulgas põhjustab elektronide vahetus tihti kuumust).
Mõned näited
Kaalium- ja naatriumsalpeeter. Esimest on kasutatud püssirohus ning teist on kasutatud väetise ja raketikütusena.
Ammoonium nitraat on kasutusel väetisena ja osade poolt väetispommides.
Glütserool ja sellest saadud nitroglütseriin.
Tselluloos ja nitrotselluloos. Klipp nende kahe põlemiskiiruste erinevusest. Tselluloosi leidub suvalises taimerakke sisaldavas materjalis. Nitrotselluloosi üks uurija tegi puuvillasele põllele nitraatiooni sisaldava happega kokku ja kui ta selle pliidi kohale kuivama jättis, siis see põll plahvatas mingi aja mõõdudes. Nobel kasutas sama hapet nitroglütseriini tootmises ning mõlemal juhul kinnitus see nitraatgrupp algmaterjali -OH gruppide külge. Samuti liitub see grupp tärklise ja poolsuvalise teise -OH rühmi sisaldava ainega.
TNT.
C-4 koostises olev RDX. Kaalu arvestades ~1,5 korda võimsama plahvatusega kui TNT.
Subscribe to:
Posts (Atom)


Annulene-3D-balls.png)